暨南大学理工学院汪勇教授课题组的陈楠楠博士在Food Hydrocolloids期刊(中科院JCR 1区(2020升级版),影响因子5.839)发表了一篇关于利用大豆球蛋白凝聚构建核-壳结构微凝胶及其性质研究的文章。论文标题为“pH and ionic strength responsive core-shell protein microgels fabricated via simple coacervation of soy globulins”,由汪勇教授指导并为通讯作者。

研究背景:
蛋白微凝胶是具有微型凝胶网络结构的微颗粒,可用于包埋食品成分和调节凝胶流变性能等。大豆球蛋白自凝聚体在加热条件下可以转变为空心微胶囊。β-伴球蛋白可在一定程度上抑制球蛋白相分离并在一定添加比例下使其转变为实心的微凝胶。然而,基于大豆蛋白凝聚制备的微胶结构和性质尚不明确。大豆分离蛋白中β-伴球蛋白与球蛋白比例正好位于可形成微凝胶的比例范围内。因此,本项目以大豆分离蛋白为原料,探讨其形成微凝胶的条件,并研究形成的大豆分离蛋白微凝胶的环境响应性和控释性质。
研究方法:
通过浊度和微观结构变化研究盐离子浓度,pH和蛋白浓度对球蛋白在大豆分离蛋白溶液中发生自凝聚的影响。在80 °C条件下使球蛋白凝聚体与溶液中β-伴球蛋白相互作用并形成微凝胶。离心分离出形成的微凝胶颗粒,将其重新分散在纯水中。调控溶液pH和离子强度,用激光共聚焦显微镜观察微凝胶环境响应性。以溶菌酶为模式活性蛋白,研究微凝胶对其包封和控释作用。
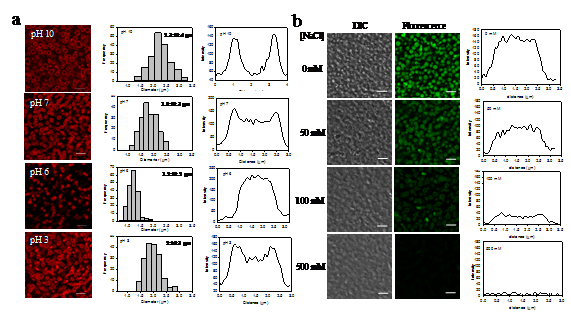
图1 a) pH对SPI微胶溶胀性质影响;b) 盐离子调控溶菌酶从微胶中释放
研究结果:
在一定条件下,可以诱发球蛋白在大豆分离蛋白溶液中发生自凝聚,并通过加热使其与β-伴球蛋白相互作用形成微胶。通过调节pH或离子强度,可以改变凝胶内蛋白分子间静电相互作用,从而控制微凝胶溶胀。当分子间静电排斥作用增加时,SPI微胶溶胀并呈核-壳结构;反之,微胶收缩,核-壳结构消失。通过调控静电相互作用,SPI微胶可用于包封溶菌酶并控制其释放。
研究结论:
研究结果体现了利用大豆球蛋白自凝聚可以构建具有环境响应性的核-壳结构微凝胶,过程简单且易控制,为植物蛋白新型微凝胶制备提供新思路。
研究工作受到博士后创新人才支持计划,博士后面上项目,广东省自然科学基金面上项目的支持。
参考文献:
Chen, N.; Nicolai, T.; Chassenieux, C.& ; Wang, Y. pH and ionic strength responsive core-shell protein microgels fabricated via simple coacervation of soy globulins. Food Hydrocolloids, 2020, 105, 105853.
原文地址:https://www.sciencedirect.com/science/article/pii/S0268005X1932942X
作者介绍:

陈楠楠,博士后。研究兴趣包括油脂副产物综合利用基础,生物大分子定向自组装和相行为调控/设计/应用和脂质囊泡结构调控/设计/应用。入选了2019年全国“博新计划”,获得了博后面上项目和广东省自然然科学基金面上项目。


